RNA作为DNA的转录产物,包括组成型RNA、表达型RNA和调节型RNA。RNA参与生物机体的重要生命活动,也是一直以来的研究热点,如:疾病相关基因转录组或表达谱的研究及科学研究相关基因的表达水平qPCR检测。有关RNA的实验,首先要获得优质的RNA样品,本文将会跟大家分享如何获得高品质的RNA。
RNA提取基本原则
RNA提取的基本原则是从目标样本中提取出完整度好、纯度高的优质RNA,主要避免在样品的保存或RNA提取过程中,RNase对RNA的降解。
样品保存
拿到样品后如不能立刻进行提取,需要对样品进行液氮速冻,之后于-80℃保存;不建议直接将样本放于-20℃亦或是-80℃进行储存,由于在缓慢降温过程中,随着细胞的死亡,细胞内的溶酶体破裂,溶酶体内的RNase会释放出来使样本中的RNA降解。
样品保护
在没有液氮的实验条件下,如野外采样等,不能对样品立刻进行速冷时,可以利用一些保护试剂如RNA hold对样品进行保存;其主要成分是非特异性蛋白酶变性剂,能够失活样本内源性的RNase,从而保护RNA的完整性。
RNA提取方法选择
拿到样品后,需要根据样品的种属,如动物样品或植物样品;亦或是样本状态,诸如是动物组织或是动物细胞,进行提取试剂和相应提取方法的选择。
RNA提取方法包括两种,一种是胍盐法:其能够有效裂解细胞,同时抑制RNase活性、保持RNA完整度;下游可用硅胶柱亦或是异丙醇进行RNA富集,其特点是提取量大。提取试剂如:EasyPure® RNA Kit;Viral DNA/RNA Kit;Plant RNA Kit;Blood RNA Kit。另一种是CTAB法:其在裂解细胞时能够避免多糖多酚与RNA的结合,同样下游可用硅胶柱法亦或是异丙醇进行RNA富集,其主要适用于植物样品尤其是多糖多酚类样品RNA的提取。提取试剂如TransZol Plant。
RNA提取注意事项
● 实验人员需要穿实验服,佩戴手套和口罩亦或头套,以防止皮屑、唾液及头屑中RNase的引入;
● 提取RNA所用操作台最好是专用的,或干净的且人流量小的区域,以避免外源RNase的引入;
● RNA提取所用耗材如EP管或枪头等需进行DEPC处理(0.1%DEPC水浸泡过夜,高压灭菌后烘干即可使用)以失活RNase,或购买RNase-free的耗材直接使用;提取时所用的有机试剂如70%乙醇需要用RNase-free水或0.1%的高压灭菌的DEPC水进行配置;
● 用于组织研磨的研钵,使用前需要用酒精灼烧,以失活研钵可能残存的RNase;
● 提取RNA时所用的有机试剂如氯仿或异丙醇要与提DNA的分开使用,以避免外源RNase的引入;
● 整个提取过程在低温条件下快速提取,以降低RNA降解的风险。
RNA检测
提取完RNA后需要对RNA进行检测,包括分光光度计、琼脂糖凝胶电泳及Agilent’s RNA LabChip and 2100 Bioanalyzer分析等,以检测RNA的浓度、纯度和完整度。
分光光度计检测:主要用于RNA的浓度及纯度测定,不能进行RNA完整度检测。其两个重要参数包括A260/280及A260/230;纯度较好的RNA,A260/280为2.0左右,如果比值小于2.0,RNA中有蛋白残留;A260/230为2.0-2.2之间,如果比值小于2.0,RNA中含有有机试剂,如酚、乙醇或糖类的残留。
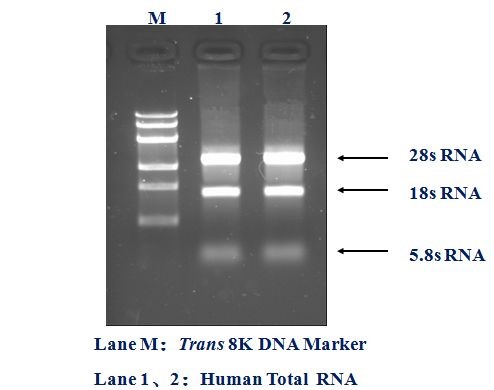
琼脂糖凝胶检测:可以进行RNA完整度分析,但其不能对RNA实现准确定量或是否有杂质如有机试剂,如酚、乙醇或糖类的残留进行检测。最终通过RNA条带完整度来判断RNA是否降解或有基因组(gDNA)残留。
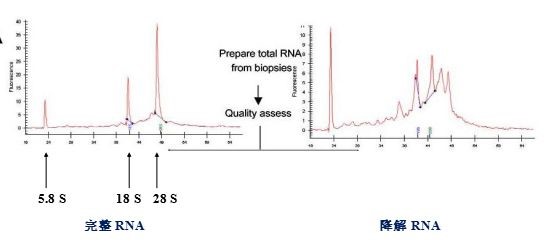
Agilent’s RNA LabChip and 2100 Bioanalyzer进行RNA品质分析:主要通过峰图位置及峰图高度或面积来分析RNA的完整度和浓度,同时可检测RNA中是否有基因组(gDNA)的残留;但其不能检测RNA的纯度即是否有蛋白或有机试剂污染。此检测方法成本比较高,一般适用于对RNA质量要求比较高的实验,如二代或三代测序。
上述任一方法均不能同时检测RNA的浓度、纯度及完整度,需要使用其中任意两种方法同时对RNA进行分析,以保证RNA的品质。
基因组(gDNA)去除
如果提取的RNA有gDNA残留,需要去除gDNA以避免其对后续qPCR定量的影响,即使用DNase I 消化去除。
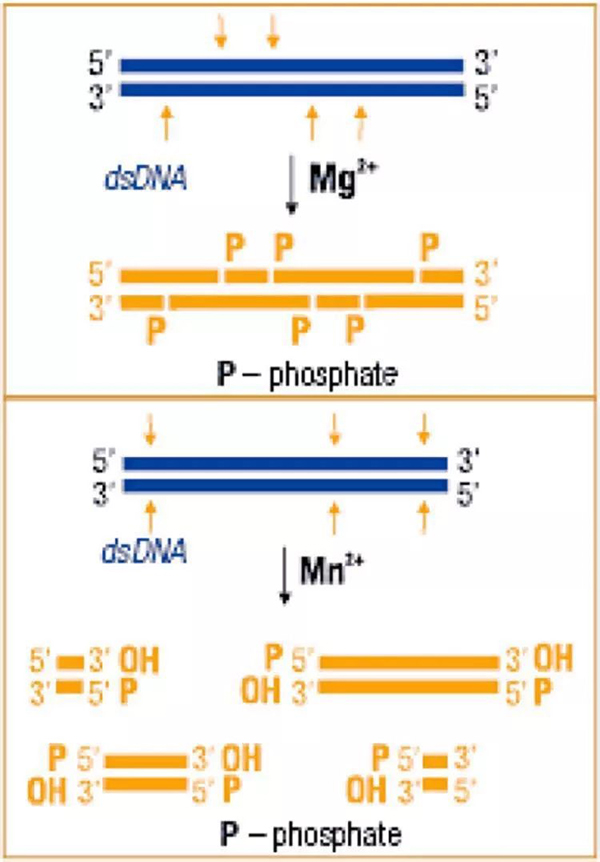
DNase I 活性严格依赖于Ca2+;在Ca2+存在条件下,如果反应体系中含有Mg2+,DNase I 会对gDNA进行随机切割,消化为小的DNA片段;如果体系中含有Mn2+,DNase I 会特异性识别特定位点,将gDNA消化为长度不一的DNA片段。
EDTA、 SDS、DTT/β-ME、高盐(>100 mM)等会严重影响DNase I 活性。
DNase I 失活
方法一:根据DNase I 活性严格依赖于Ca2+这一特性,可在浓度为2.5 mM EDTA条件下,将含有DNase I 的RNA 65℃加热10 min,使DNase I 失活。
方法二:DNase I 作为蛋白,可利用酚氯仿进行抽提去除。
通过上述一系列操作之后,即可得到无gDNA残留、纯度高且完整度好的RNA,以作为后续实验的底物。除了关注实验的各项注意事项外,高品质的产品同样至关重要,可以让实验事半功倍。全式金生物提供多款RNA提取产品,针对于病毒、植物、细胞/组织、血液等不同样本设计,提供柱提法、磁珠法和自动化提取方式,满足不同客户需求,欢迎有需要的小伙伴联系我们。