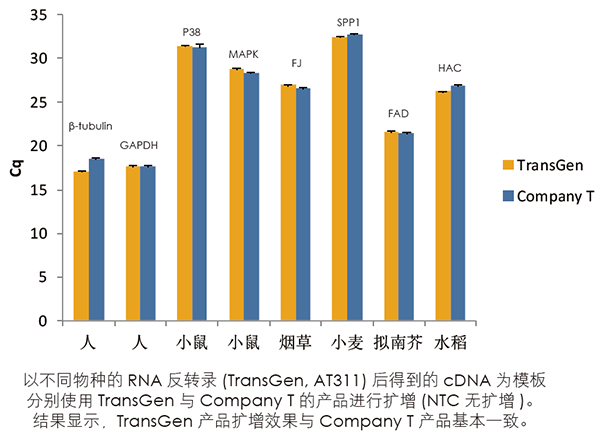
荧光定量数据有效性分析
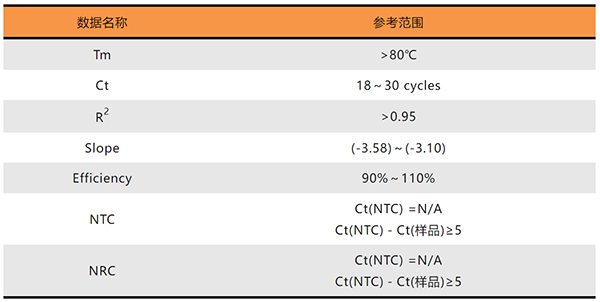
判断荧光定量数据的有效性,可以结合扩增曲线,溶解曲线,标准曲线以及NTC(检验引物)和NRC(检验模板)来分析。
扩增曲线应呈现出平滑的S型曲线,起始无扩增,起峰时间正常,由扩增曲线得到的Ct值是判断实验成功与否的重要参考,Ct值有一定的可信范围,临床检验小于33,科学研究小于38,内参基因一般小于20,且样品间内参的Ct值差不超过1,表明内参基因表达量稳定,复孔Ct值标准偏差不超过0.5;
溶解曲线应呈现单峰,峰的宽度较小,NTC和NRC无特异的峰出现;
标准曲线的斜率范围-3.58~-3.10,对应引物的扩增效率范围90%~110%,R2代表线性拟合度,一般大于0.95;
NTC用于判断反应是否存在模板污染,引物是否特异,是否会形成引物二聚体。NTC最佳状况是没有扩增,即扩增曲线和溶解曲线与基线重合,没有Ct值。NTC有扩增的情况下,至少与加入模板体系的Ct值相差5或10以上;
NRC用于判断cDNA模板中是否存在基因组DNA残留,可以间接反映RNA中基因组DNA污染情况,理想情况下,NRC没有Ct值,有Ct值的话至少要跟加入cDNA模板体系的Ct值相差5或10以上。荧光定量标准数据参考范围见下表格:
荧光定量常见问题解析
1. Ct值出现过晚(>38):
a. 扩增效率低 ,反应条件不够优化,可以重新设计引物或探针、更换灵敏度更高的试剂、改用三步法反应,降低退火温度;
b. 反应成分降解或模板量偏低,可以设置阳性对照、检查RNA质量、提高反转录效率、采用一步法qRT-PCR;
c. PCR产物太长,可以重新设计引物,扩增长度建议100-200 bp。
2. 无Ct值或无信号:
a. 循环数偏少,建议扩增循环数35以上,可以根据具体情况增加循环数至45;
b. 信号采集设置有误,三步法建议在72℃延伸采集,确定设置了采集信号指令;
c. 引物或探针失效,建议设置阳性对照、探针退火温度偏低,凝胶电泳检测是否存在扩增产物;
d. 模板不足或降解,建议检测RNA质量、提高反转录效率、避免cDNA反复冻融、使用探针法;
e. 阈值设置不正确,阈值建议在指数期进行手动调整。
3. 扩增曲线S型异常(图一):
a. ROX添加不当,建议根据机型选择合适的ROX;
b. 模板浓度过高,可以适当稀释模板,减少扩增抑制;
c. 基线设置不正确,基线期起始于3-10个循环,终止于指数扩增前,有些机型可以手动调整。
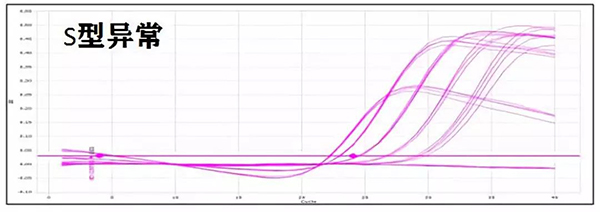
图一
4. 扩增曲线平台期不平滑(图二):
a. 探针或荧光染料品质不好;
b. 仪器使用过度,荧光收集不稳定;
c. 仪器未经过校正(包括自动校正或ROX校正);
d. 体系中抑制物较多,导致荧光不稳定。
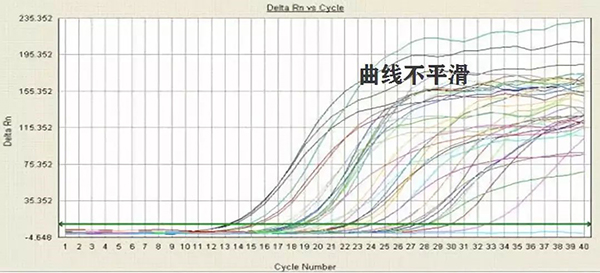
图二
模板中抑制物包括多糖类,有机溶剂,蛋白酶K等,可以参考之前给大家介绍的RNA品质检测内容。一般cDNA中存在抑制物可以在反转录前对RNA进行梯度稀释,分别进行反转录,可以减少或消除抑制物的影响(参见图三)。

图三
5. 扩增精密度差(图四):
a. 加样误差,建议引物和qPCR Mix先预混,分装后加模板;
b. 体系配置错误,仔细检查操作步骤;
c. 反应液没有混匀,充分涡旋混匀;
d. 低拷贝基因或模板浓度过高或过低,调整模板上样量,cDNA原液加入体积不超过体系总体积1/10;
e. 未引入校正系统,根据机器型号加入ROX。
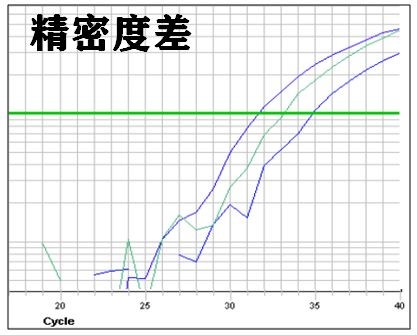
图四
6. 溶解曲线不是单峰(图五):
a. 引物设计及用量问题,建议重新设计退火温度较高(58~62℃),无错配,Blast比对特异的引物、引物用量合适(0.2~0.4 μM);
b. 模板有基因组污染,建议优化RNA提取方法,选择合适的反转录试剂,跨内含子设计引物;
c. 基因表达量低,建议增加反转录效率,适当提高模板量,选用一步法qRT-PCR;
d. 扩增体系不佳,可以使用灵敏度高,特异性强,封闭技术先进的试剂。
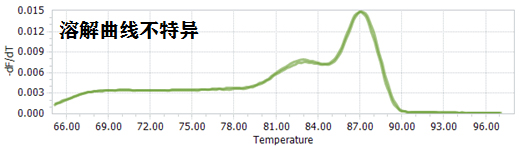
图五
7. 标准曲线线性关系不佳(图六):
a. 加样误差,建议标准品加样体积大于2微升、引物预混后再分复孔,定期校正移液器,尽量选择硅化枪头,使用文库稀释液稀释标准品,降低耗材管壁对DNA吸附;
b. 标准品降解,应该避免反复冻融、电泳检测发现降解后重新制备稀释标准品;
c. 模板浓度高或有抑制物,可以改变稀释精度,增加稀释梯度;
d. 引物或探针不佳,重新设计引物和探针;
e. PCR酶灵敏度不高及活力下降,建议更换灵敏度更高,线性关系更好的试剂,校正-20℃冰箱,使用时将酶置于冰上。
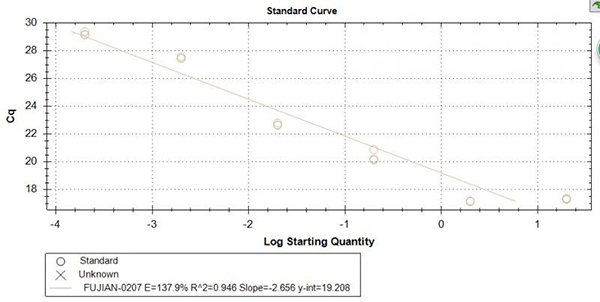
图六
8. NTC有扩增:
a. 水,试剂或引物污染,可以分装水和引物,试剂优先于引物和模板加入到体系中;
b. 引物二聚体,建议优化引物设计,提高退火温度(58~62℃),降低引物浓度(0.2~0.4 μM);
c. PCR核心酶特异性差,可以选用封闭技术先进(全封闭)的试剂。
9. 扩增效率低:
a. 反应条件不够优化,建议降低退火温度,使用三步法,使用扩增更线性的试剂;
b. PCR抑制物,建议优化核酸纯化方法,适当稀释模板降低抑制物影响;
c. 引物设计,引物避免3’端错配、扩增片段长度在100~200 bp 。
要确保实验成功,除了关注实验的各项注意事项外,高品质的产品同样至关重要,全式金生物提供多款qPCR产品,推荐一款王牌产品给大家,性能优异,稳定性好,已助力发表多篇SCI文章,欢迎有需要的小伙伴联系我们。
PerfectStart® Green qPCR SuperMix (AQ601)
产品特点:
● 3 种抗体封闭,特异性高,灵敏度高,扩增效率强,适用物种范围广。
● 双阳离子缓冲液,增强特异性,减少引物二聚体形成,数据准确。
● 配有适用于不同机型的Universal Passive Reference Dye ( 调整PCR加样误差引起的管间差异 ),数据准确。
灵敏度高

适用于多种物种