获得单细胞克隆是生成同质化人多能干细胞群的关键步骤。常用的单细胞挑选方法包括连续稀释和细胞分选技术。连续稀释法是一种廉价的解决方案,但形成异质性细胞群的风险更高。使用细胞分选仪器可以快速有效地选择单细胞,但价格昂贵成本高。
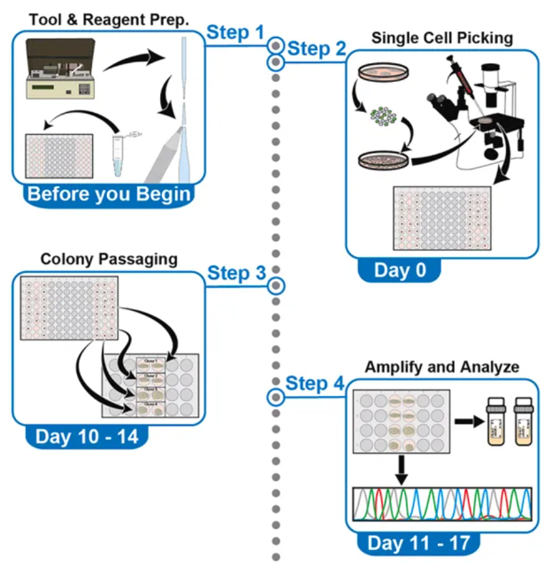
图1 使用微量移液器进行单细胞挑选的完整流程
Jack M. Parent等研究者开发了一种基于常见体外受精流程的单细胞挑选方案,方案中使用的微量移液器只能抽取1-3 μL液体,几乎不会带走非目的细胞。挑选的细胞2小时后粘附在培养皿表面。在这个阶段它们对环境变化(如温度、pH值和湿度)很敏感。细胞的最佳观察时间是挑选后第五天,此时细胞有时间分裂并形成集落。在此阶段,细胞对环境波动不太敏感。此方案挑选的单细胞预期的平均存活率为50%,甚至可能超过80%(图2D和2E)。
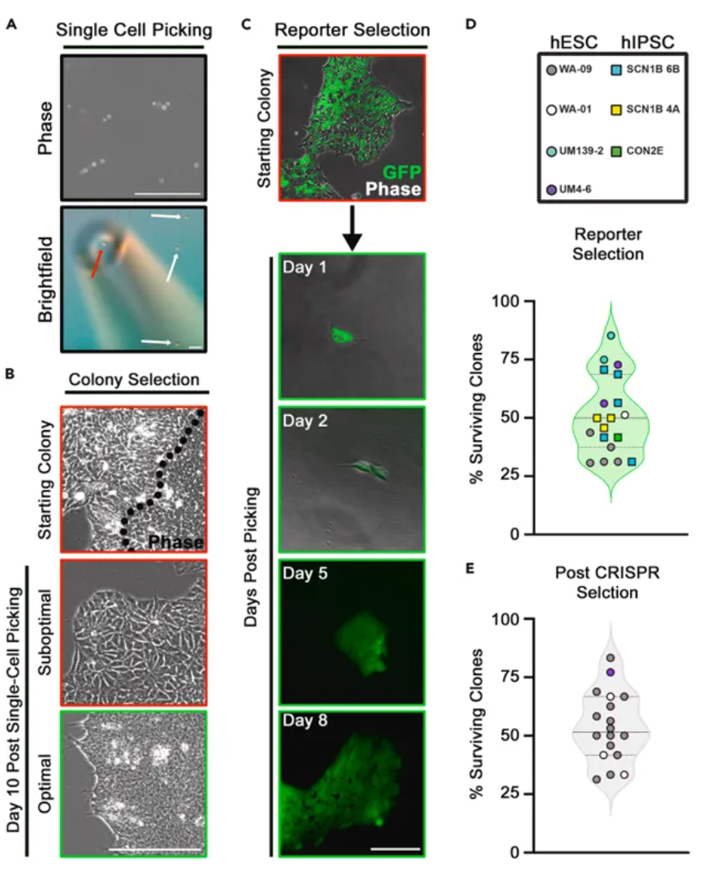
图2 使用微量移液器进行单细胞筛选,获得同质性hPSC克隆
研究者对hPSC进行转染以生成CRIPSR/CAS9编辑或GFP标记的细胞系。随后用这些细胞系以及微量移液器进行单细胞挑选,下文列出了此方案中相关操作的详细步骤。
第0天:96孔板准备
1.使用Laminin对96孔板进行包被:在96孔板的每孔中加入包被溶液后,在 37°C、5% CO2培养箱中孵育至少2个小时或过夜。包被溶液:57 μL 1 X DPBS(含Ca++/Mg++)中加入3 μL CellAdhere™ Laminin-521(96孔板的每个孔)。
2.从96孔板的每个孔中吸出Laminin溶液。
3.在每个孔中添加100 μL预热的克隆培养基。克隆培养基:90% mTeSR™ Plus + 10% CloneR™2注意:将克隆培养基轻轻分配到每个孔中,以避免破坏Laminin-521包被。
4.实验开始前,将其放入37°C、5% CO2的培养箱中1小时。
第0天:单细胞解离
使用ACCUTASE™细胞解离试剂将细胞轻轻解离成单细胞溶液。4.从培养箱中取出组织培养容器并将其放入生物安全柜中。
5.从容器中吸出培养基,用1 mL室温1 X DPBS(不含Ca++/Mg ++)清洗。
注意:该体积指的是6孔板每个孔的或35 mm组织培养皿的体积。
6.从上一步中吸出DPBS,并用1 mL ACCUTASE™细胞解离试剂替换,然后将板放回培养箱中5-7分钟。
注意:解离所需的时间因细胞系而异,应通过测试来获得最佳活力 (>90%)。
7.从培养箱中取出培养皿并将其放入生物安全柜中。
注意:此时大多数细胞集落应该已经悬浮。
8.从培养皿底部收集剩余的集落:
a.使用p1000微量移液器吸取细胞悬浮液并将剩余的粘附集落从培养皿中吸出;
b.轻轻地上下吹打两次,将细胞聚集体分离成单个细胞;
c.将细胞混合物转移到15 mL离心管中,然后立即添加9 mL DMEM F-12培养基以中和ACCUTASE™反应。9.在室温下以200 g离心5分钟,吸出上清液,然后将细胞沉淀轻轻悬浮在1 mL mTeSR™ Plus培养基中。
10.使用台盼蓝计数活细胞。
注意:如果细胞活力低于80%,请勿继续。
11.使用预热的mTeSR™ Plus培养基在35 mm未处理的培养皿中将单细胞溶液稀释至约1000个细胞/mL。
注意:(a)为防止单细胞附着在培养皿上,此步骤中应使用未经处理的培养皿。(b)当细胞密度高时,很难进行单细胞挑选,这可能导致一个孔中接种多个细胞。
12.前后摇动培养皿以分离单个细胞。
13.将单细胞悬浮液放入37°C培养箱中5分钟,让细胞沉淀但不要附着在培养皿底部。
第0天:单细胞挑选
14.将预切割的硼硅酸盐玻璃微量移液器吸头连接到水平层流柜/洁净工作台中的微量移液器上。
15.从培养箱中取出含有单细胞悬液的35 mm培养皿和含有克隆培养基的Laminin-521 涂层96孔板,并将它们放置在水平层流柜/洁净台中。
16.在倒置显微镜下,以4倍或10倍放大倍数使用微量移液器挑选单个细胞。
a.将微量移液器上的活塞压至第一档,小心地将吸出所需细胞(约 1 μL)
b.将移液器吸头插入含有mTesR™ Plus与CloneR™2的Laminin-521预包被的96孔板的一个孔中
c.将移液器活塞压下至第二档,将细胞排出至孔中。
注意:请避免移液器吸头刮伤板或孔的底部。
17.重复步骤16,直到挑选出所需数量的细胞。
注意:为了最大限度地保持细胞活力,我们建议细胞在培养箱外的时间不超过30分钟,以避免培养基pH值发生变化。
18.将含有单细胞的96孔板放置在组织培养箱的后端,在37°C、5% CO2的环境下培养2天。
第1天至10/14天:单细胞维持培养
19.第2天,使用预热的100 μL克隆培养基进行全换液。
注意:使用200 μL移液器将培养基从孔中吸出。
20.第3天,向每个孔中另外添加25 μL预热的新鲜克隆培养基(初始体积的25%)。
21.从第4天到10/14天,每天使用预热的mTeSR™ Plus进行完全换液。
注意:集落可在第10天或第14天传代。
第1天至10/14天:荧光报告基因确认
在荧光显微镜下进行目视检查以确认荧光报告基因的表达。22.第1天,使用Evos成像系统或其他所需系统检查荧光信号(图2C)。
注意:定期检查每个孔,以确保目标孔保持报告基因表达。在恢复和扩增期间,某些细胞中的报告基因表达可能会被抑制。
23.对具有不同报告基因表达水平的多个单细胞克隆进行传代。注意:由于病毒整合是随机发生的,如果细胞中发生多个整合事件,则可能引起毒性。
第10至14天单细胞扩增24.用500 μL Geltrex溶液包被24孔板。
注意:Laminin-521仅用于增强单细胞在挑选后的附着。单细胞衍生集落的后续传代可使用Geltrex和Matrigel等常规基质进行。
25.将24孔板放入37°C培养箱中孵育至少30分钟或过夜。
26.从培养箱中取出含有单细胞集落的96孔板,并在Geltrex培养时间完成前约5分钟将其放入生物安全柜中。
27.从96孔板中吸出培养基,并用100 μL 1 X DPBS(不含Ca++/Mg++)清洗每个孔。
28.每孔添加100 μL 0.8 mM EDTA溶液(pH 7.2)。
29.将96孔板放入37°C培养箱中培养5-7分钟。
注意:与ACCUTASE™解离类似,EDTA孵育时间取决于细胞系,应根据经验确定。
30.在EDTA孵育期间,从24孔板中吸出Geltrex溶液,然后向一个孔中添加480 μL mTeSR™ Plus培养基,并向另一个孔中添加420 μL培养基。
注意:不同的体积反映了CRIPSR基因编辑后筛选克隆的需求。480 μL的孔用于维持培养,420 μL用于基因组DNA (gDNA) 提取。如果单细胞克隆用于分离iPSC报告系或群体选择,请使用相同的体积并在每个孔中接种相同数量的细胞。
31.将96孔板放回生物安全柜并小心吸出EDTA溶液。
32.将100 μL mTeSR™ Plus培养基添加到96孔板中,上下吹打,轻轻地将大细胞团块分离成较小的碎片。
注意:更换孔之间的吸头以避免交叉污染。
33.将20 μL细胞悬浮液添加到含有480 μL mTeSR™ Plus 培养基的24孔板的一个孔中,使总体积达到500μL。
34.将剩余的80 μL细胞悬浮液添加到含有420 μL mTeSR™ Plus培养基的第二个孔中。
35.将培养板放回37°C、5% CO2的细胞培养箱中。注意:hPSC维持培养基的切换可能会降低细胞活力。
第11-17天:基因组编辑确认
提取基因组DNA (gDNA) 以评估基因编辑效率。
36.根据步骤27-32获得细胞。
注意:可以快速冷冻细胞沉淀物并稍后进行gDNA提取。
37.使用试剂盒提取gDNA。
关键:一旦提取出gDNA将其存储在−20°C冰箱中,直到进行下一步38.扩增感兴趣的区域并对纯化的PCR产物进行Sanger测序(图3B)。39.使用在线软件评估基因编辑效率和插入/缺失模式。40.使用NGS在选定的克隆上确认插入/缺失模式。41.在开始下游分析之前,进行基因完整性分析以确保没有混杂的染色体异常。42.随后可进行下游分析,如RT-qPCR、免疫印迹和免疫染色。
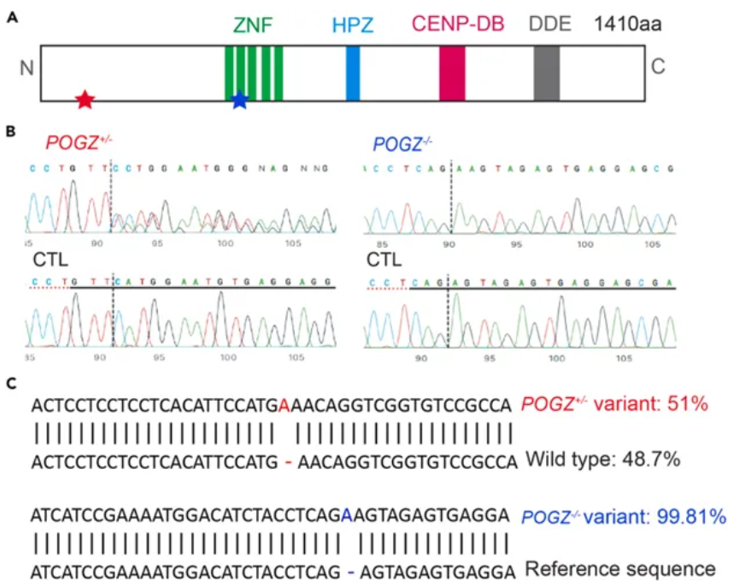
图3 微量移液器单细胞筛选可用于分离CRISPR/CAS9基因组编辑集落