癌症治疗中,抗PD-1单抗等免疫检查点阻断疗法(ICB)可以增强免疫治疗效果,但对不同个体具有不同的疗效,而差异原因尚不清楚。2024年3月14日,浙江大学医学院附属第二医院王良静教授团队和浙江大学邵逸夫医院陈淑洁主任医师团队,合作在国际顶刊Cell上发表了题为“Microbial metabolite enhances immunotherapy efficacy by modulating T cell stemness in pan-cancer”的论文,研究发现,肠道共生菌约氏乳杆菌与梭状芽孢杆菌合作产生的色氨酸代谢物吲哚-3-丙酸(IPA)可以增强Tcf7基因超级增强子(SE)上H3K27的乙酰化,从而促进CD8+ T细胞向Tpex细胞的分化,增强其对肿瘤细胞的杀伤力,在结直肠癌、乳腺癌、黑色素瘤等实体肿瘤中的疗效显著。
发现肠道菌群“约氏乳杆菌”影响抗癌效果
当患有肿瘤的小鼠被给予相同剂量的αPD-1治疗时会有反应良好和不良两种情况,为了探究这两种小鼠的肠道菌群差异,使用宏基因组测序(mNGS),数据分析后发现两组小鼠之间约氏乳杆菌(Lactobacillus johnsonii)的丰度存在显著差异(图1)。αPD-1处理的小鼠在食用活的L. johnsonii后,血浆中色氨酸代谢途径与其他组别出现显著差异,其中吲哚-3-丙酸(indole-3-propionic acid,IPA)的差异最为显著,经验证,CD8+ T细胞小鼠在接受IPA预处理后比未接受IPA预处理时,确实表现出更好的αPD-1响应(图2)。
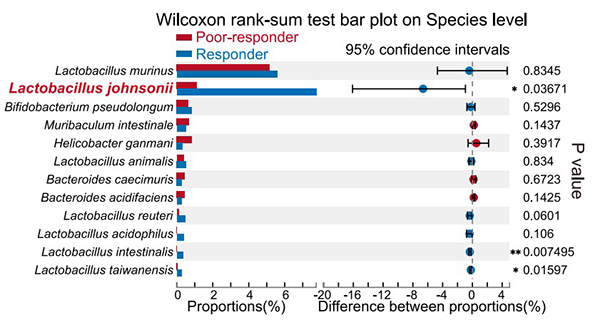
图1. 反应良好小鼠和反应不良小鼠粪便微生物群落组成
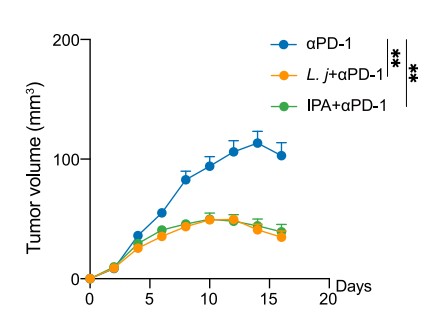
图2. 不同处理下小鼠皮下Mc38肿瘤的体积变化
如何影响抗癌疗效?T细胞Tpex变多了
肿瘤微环境中的浸润T细胞在ICB治疗中发挥重要作用,但CD8+ T细胞包含多种细胞亚群,为了确定不同细胞亚群的作用,对αPD-1和IPA处理小鼠的CD8+ T细胞进行了scRNA-seq、scTCR-seq和scATAC-seq分析(图3),结果发现IPA处理后显著增加了肿瘤中的Tpex细胞,具有干细胞特性的Tpex细胞能表现出自我更新、增殖和分化为效应CD8+ T细胞(Teff),从而提高ICB的应答性,增强免疫治疗效果。
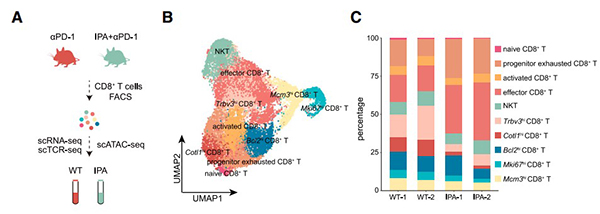
图3. IPA通过促进Tpex细胞的活性来维持CD8+ T细胞的反应
A. scRNA-seq、scTCR-seq、scATAC-seq实验设计;
B. CD8+ T细胞的单细胞RNA测序和UMAP聚类;
C. CD8+ T细胞中细胞类型及占比。
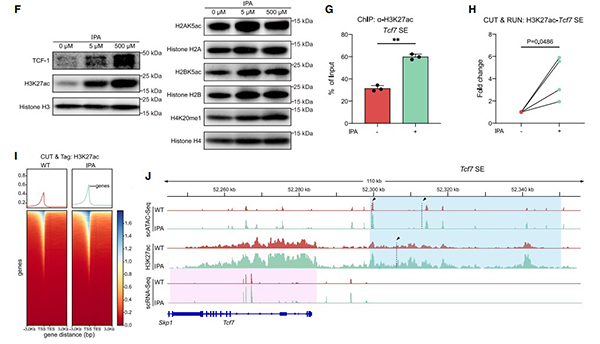
图4. IPA通过修饰Tcf7基因SE区域的H3K27乙酰化来激活Tpex细胞
F. Western blot检测CD8+ T细胞中TCF-1、H2AK5ac、H2BK5ac、H3K27ac、H4K20me1的表达量;
G. ChIP-qPCR检测CD8+ T细胞中Tcf7基因超级增强子位点的H3K27ac丰度;
H. CUT&RUN-qPCR检测CD8+ T细胞中Tcf7基因超级增强子位点的H3K27ac丰度;
I. CUT&Tag-seq检测CD8+ T细胞中Tcf7基因超级增强子位点的H3K27ac丰度;
J. scATAC、scRNA-seq、CUT&Tag联合分析Tcf7基因位点的基因组结合模式。
进一步研究发现,L. johnsonii单一菌种并不能直接合成IPA,而是需要与梭状芽孢杆菌(C. sporogenes)协作将ILA转化为IPA,免疫荧光(Immunofluorescence,IF)也证实了IPA处理能够增加乳腺癌、黑色素瘤和结直肠癌肿瘤微环境中Tpex细胞的渗透。
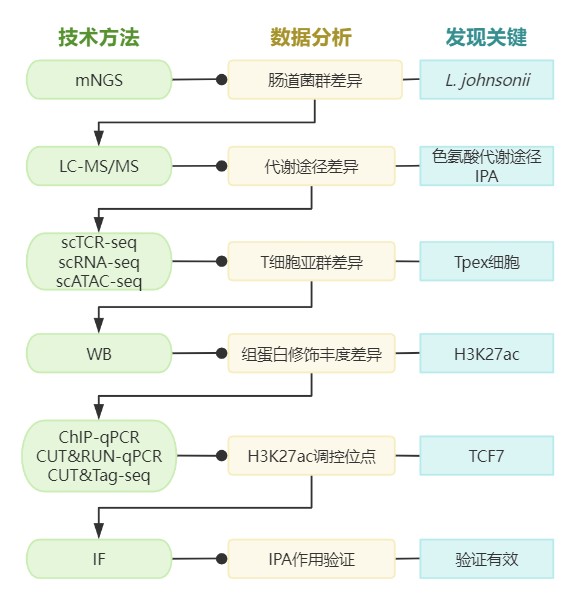
图5. 研究思路与技术路线
在蛋白质-DNA互作研究中研究者使用CUT&RUN-qPCR(Vazyme #HD101)和CUT&Tag-seq(Vazyme #TD904)试剂盒解析了CD8+ T细胞启动干性程序的表观遗传机制。
这两款试剂盒用于蛋白质-DNA互作研究,具有细胞投入量低、实验周期短、信噪比高、重复性好等优势,广泛应用于早期胚胎发育、干细胞、肿瘤、神经、免疫等表观遗传学研究领域中。